| Головна » Статті » Рак стравоходу |
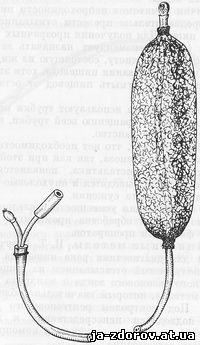
Діагностика раку стравоходу в ряді випадків пов'язана з великими труднощами. Тому дуже актуально поповнення арсеналу діагностичних методів розпізнавання раку стравоходу яким-небудь достовірним і безпечним методом, яким і є цитологічне дослідження. Цитологічні дослідження, або, точніше, методи клінічної цитології, отримали за останні десятиліття широке поширення в діагностиці злоякісних новоутворень різної локалізації. В даний час опубліковано значну кількість робіт з описом методики взяття і дослідження матеріалу, а також з оцінкою ефективності даного методу в діагностиці раку стравоходу. Всі описані методи можуть бути об'єднані у п'ять груп: 1) абразивні, 2) іригаційні, 3) аспіраційні, 4) контактні і 5) застосовуються при езофагоскопа. Абразивні методи. Отримували для дослідження матеріал з стравоходу за допомогою абразивного балона, запропонованого Panico та ін. для діагностики раку шлунка. «Абразивний шлунковий зонд-балон складається з двох вставлених одна в іншу трубок-зондів, абразивного балона, гумової груші для нагнітання повітря і шприца для відкачування шлункового вмісту. Діаметр внутрішньої гумової трубки 5 мм, діаметр зовнішньої хлорвінілової трубки 7 мм. Таким чином, між двома трубками залишається простір, що забезпечує вільне проходження повітря в балон і назад.До дистальному кінця зонда прикріплена металева олива, що сприяє кращому проходженню зонда в антральний відділ шлунка. На відстані 3 і 18 см проксимально від оливи всередині хлорвінілової трубки знаходяться два металевих кільця. Абразивний балон виготовлений з тонкої гуми; для додання шорсткості на зовнішню поверхню балона наклеєний шар гумової стружки або на нього надівається шовкова сіточка з 250 вузликами. Балон прикріплений шовковою ниткою до тих ділянок зонда, де знаходяться всередині металеві кільця. Для проходження у балон повітря в хлорвінілової трубці між кільцями є кілька отворів. На відстані 90 см від оливи з допомогою металевого переходу гумова трубка виведена через стінку хлорвінілової трубки. До вільного кінця хлорвінілової трубки за допомогою скляного переходу приєднується гумова груша. Гумова трубка закінчується металевою втулкою для приєднання шприца» (цит. за І. Т. Шевченка, 1962). Після введення натще зонда і відкачування вмісту шлунка зонд просувають до пилоруса і, ввівши в балон через грушу повітря, витягають зонд з таким розрахунком, щоб балон досяг кардії. Цю процедуру повторюють 5 разів, поєднуючи її з промиванням шлунка фізіологічним розчином і наступним відсмоктуванням його шприцом. Після виймання зонда досліджують осад промивних вод, отриманий центрифугуванням, і дрібні тканинні частинки, фиксировавшиеся на стінці балона (рис. 39).
Іригаційні методи. Деякі лікарі негативно ставляться до абразивним методів отримання матеріалу, вважаючи, що вони значно і невиправдано ускладнюють дослідження; крім того, морфологічні особливості клітин, отриманих безпосередньо з місця ураження, менш чітко виражені, ніж у клітин, отторгшихся в результаті природної десквамації. Остання обставина є причиною неточних висновків, тому автори віддають перевагу іригаційним методів, при яких матеріалом для дослідження служать промивні рідини стравоходу. Дослідження проводиться натще не раніше ніж через 12 годин після прийому їжі і через 48 годин після введення барію. За допомогою рентгенологічного дослідження встановлюється рівень розташування патологічних змін. У сидячому положенні хворого вводять трубку Левіна № 20 на глибину 45 див. Хворий випиває 100 мл розчину Рінгера або фізіологічного розчину, які негайно відсмоктують, тобто, виходить змив з усієї поверхні стравоходу. Потім трубку поступово витягають і кожні 5 см повторюють промивання 50 мл розчину Рінгера. Особливо енергійно промивають на рівні, де передбачається наявність патологічного процесу.Якщо при аспирациях промивну рідину отримати назад не вдається, то всю процедуру проводять в лежачому положенні. Промивні води хворого швидко центрифугують і осад досліджують під мікроскопом. Застосовуються іригації муколітичними речовинами - папаїном, лаурилсульфатом, соликонами і а-хемотрипсином, на думку і ін., не підвищують відсотка виявлення пухлинних клітин у промивних водах. При наявності симптомів непрохідності стравоходу необхідно попередньо провести відмивання стравоходу від залишків їжі. Для одержання прозорих промивних вод рекомендують призначати за кілька днів до дослідження дієту, що складається з рідкої їжі, або щоденні промивання стравоходу, хоча це не завжди дозволяє повністю відмити стравохід від залишків їжі та слизу з бронхів. При явища стенозу використовують трубки меншого діаметру і вдаються до обертання всієї трубки, вводячи її кінець звужене простір. Рубін (1961) вважає, що немає необхідності проводити трубку нижче рівня стенозу, так як при цій маніпуляції посилюється перистальтика, з'являється блювота і з блювотними масами виводяться і пухлинні клітини, що накопичилися нижче місця звуження. Велике значення для успішності дослідження має максимально швидка обробка промивних вод, приготування і фіксація препаратів. Аспіраційні методи. В. Т. Шевченка (1949, 1952, 1957) для діагностики раку стравоходу досліджував матеріал, отриманий з відсмоктуванням стравоходу за допомогою тонкого гумового зонду і мандрена з м'якого, гнущегося металу, який значно полегшував введення зонда. Під контролем рентгенівського екрану кінець зонда підводився безпосередньо до місця ураження і після видалення мандрена з допомогою шприца вироблялося відсмоктування. Автор зазначав, що запропонований ним метод безпечний, дає можливість у разі необхідності повторювати дослідження і не вимагає великої кількості часу. Великою перевагою методу є аспірація матеріалу безпосередньо біля місця розташування пухлини. Кандарджис (1963) для прицільної аспірації користувався зондом «Camus» або катетером з великою кількістю отворів на металевому кінці.Зонд або катетер під контролем рентгенівського екрану або езофагоскопа підводили до місця ураження. Аспірація проводилася шприц ємністю 20 мл; через кілька секунд зонд або катетер витягувався із стравоходу. Метод, на думку автора, простий, безпечний, забирає мало часу і дозволяє отримати достатню кількість матеріалу для дослідження.
На 5 Всесоюзній конференції лікарів-лаборантів у 1961 р. Н. Р. Алексєєв повідомив про можливість взяття матеріалу для дослідження шляхом аспірації із стравоходу через товстий гумовий зонд за допомогою шприца Жане. Н. Р. Алексєєв користується дитячим шлунковим зондом, у стінці якого роблять ще два отвори так, щоб усі чотири отвори розташовувалися з чотирьох сторін зонда; на кінці зонда наносять насічки (рис. 40). Практичне використання рекомендацій Н. Р. Алексєєва дозволило оцінити їх як найбільш простий, безпечний і доступний в будь-яких умовах спосіб отримання матеріалу з просвіту стравоходу. Перед введенням зонда задню стінку глотки анестезируют змазуванням 2% розчином дикаїну, а проксимальний кінець зонда з'єднують зі шприцом Жане. Після введення зонда до рівня кардії відтягують поршень шприца до поділки 50 - 60 і зонд повільно витягують з просвіту стравоходу. Завдяки негативному тиску у зонд через отвори в його стінці аспірується матеріал зі всієї поверхні стравоходу. Якщо зонд витягується з працею, то поршень шприца опускають нижче (тобто зменшують негативний тиск в системі зонд - шприц) до тих пір, поки зонд не буде просуватися без зусиль. Після вилучення зонд кладуть у велику кювету і під тиском промивають 200 - 300 мл фізіологічного розчину. Для дослідження з фізіологічного розчину відбирають всі грудочки кров'янистої слизу і дрібні тканинні частинки. Контактні методи. А. Я. Альтгаузен (1946) вводив товстий зонд у стравохід до місця звуження; після виймання зонда кінець його споласкивался в чашці з водою. Всі пристали до кінця зонда тканинні частинки відмивалися водою і досліджували під мікроскопом. А. Я. Альтгаузен виявляв дрібні клаптики пухлинної тканини, що дозволяли уточнювати клінічний діагноз. Отримані частинки тканини іноді були таких розмірів, що давали можливість провести гістологічне дослідження. Кандарджис з працівниками (1963) отримували матеріал дослідження іншим способом. Полуригидный зонд обертывался стерильної ворсистою тканиною, укріпленої на зонді декількома оборотами нитки і просоченою стерильним фізіологічним розчином, і вводився в стравохід. Зіткнення зонда з пухлиною сприймається у вигляді еластичного опору просування зонда, що долають легким натиском. Більш або менш значне зусилля при цьому абсолютно неприпустимо, бо може призвести до розриву стравоходу. Коли зонд досягає місця ураження, його залишають в стравоході приблизно на годину. Після виймання зонда на ділянці тканини, соприкасавшейся з пухлиною, можуть залишатися дрібні частинки пухлинної тканини, з яких готують препарати для дослідження. Перевагою цього методу є можливість прицільної взяття матеріалу, недоліком - дуже велика кількість препаратів, які лікар повинен переглянути, а також тривалість перебування зонда в стравоході. Отримання матеріалу при езофагоскопа. Н. Р. Алексєєв (1955, 1960) досліджував мазки, приготовані з кров'янистих грудочок, які він знімав після езофагоскопа з внутрішньої поверхні езофагоскопа і з кінців щипців. Фіксація та забарвлення мазків проводилися за запропонованим автором прискореним методом. Примітно те, що у 10 з 14 хворих на рак стравоходу в досліджуваному матеріалі були виявлені пухлинні клітини і в 1 випадку результати дослідження дали можливість висловити підозру про наявність раку. Мілл (цит. за Таннер, 1961) у випадках, коли при езофагоскопа не представляється можливим взяти шматочки тканини для гістологічного дослідження, запропонував пропускати через підозрілий ділянку тонку гумову трубку з оливою. Після вилучення трубку і оливу обмивають фізіологічним розчином. Для дослідження беруть осад, отриманий центрифугуванням цього фізіологічного розчину. Мессельт (1952) матеріал з стравоходу для цитологічного аналізу брав під час езофагоскопа за допомогою ватяних тампонів. Якщо при езофагоскопа місце ураження знаходиться поза полем зору, автор вважає можливим стрижень з ватним тампоном просунути за межі видимості. З отриманого на ватному тампоні матеріалу негайно робляться мазки на предметних стеклах. У клінічної цитології застосовуються різні методи підготовки і обробки матеріалу для мікроскопічного дослідження. Найбільш простим є метод нативного препарату. Він докладно розроблений С. Л. Ерліхом та А. Я. Альтгаузеном і опублікований у численних роботах, присвячених цитологічної діагностики новоутворень у різних экскретах і секретах організму. Метод полягає в тому, що грудочку досліджуваного матеріалу поміщають на предметне скло, накривають покривним без попередньої обробки. Відбір матеріалу для мікроскопії проводять за допомогою макроскопічних пошарового дослідження, що полягає в тому, що рідкі секрети, экскреты, промивні води послідовно виливають невеликими порціями в чашку Петрі і розглядають в тонкому шарі. Матеріал, що має густу консистенцію, розтягують тонким шаром і також ретельно переглядають. Метою цього макроскопічного дослідження є виявлення найдрібніших тканинних частинок, відбір і приготування з них нативних препаратів для перегляду під мікроскопом. Тканинні частинки при огляді матеріалу неозброєним оком відрізняються від загального фону своєю консистенцією, формою і кольором; вони сіруваті, жовтуваті, іноді кров'янисті, більш щільні, ніж навколишнє середовище, і тому не розтягуються при розправленні їх препаровальными голками. Нерідко ці шматочки тканини бувають такі мізерні, що для виявлення їх доводиться вдаватися до лупі.Нарешті, вони можуть бути так малі, що відшукати їх вдається лише при мікроскопічному дослідженні. Тому, якщо при огляді матеріалу виявити тканинні частинки не вдається, готують серію нативних препаратів з будь-якого досліджуваного матеріалу (осад сечі, вміст шлунка, харкотиння тощо) і потім досліджують їх під мікроскопом. Значною перевагою нативного препарату є те, що при його приготуванні добре зберігаються клітинні комплекси. В даний час більш поширене дослідження забарвлених препаратів. Для цього з досліджуваного матеріалу готують тонкі мазки, які фіксують і забарвлюють одним з численних існуючих методів. Найчастіше забарвлюють по Паппенгейму або Романовському - Гімзе, тобто методами, застосовуваними для забарвлення мазків крові. При цих методах цитоплазма клітин забарвлюється в різної інтенсивності блакитний, синій, рожевий чи фіолетовий колір. Добре видна зернистість в цитоплазмі і детальна структура ядер, які забарвлюються в темно-фіолетовий або темно-ліловий колір. Демонстративні препарати виходять також при фарбуванні за Папаніколау. У препаратах, оброблених за його Мегодике, ядра клітин фарбуються в синьо-фіолетовий колір, оксифильная цитоплазма - в рожевий, вазофільна - в синьо-зелений колір. Еритроцити забарвлюються в коричневий, а лейкоцити - в блідо-червоний колір з жовто-синіми ядрами. В нативних і забарвлених препаратах, приготовлених з матеріалу, отриманого з стравоходу, можна виявити лейкоцити, клітини епітелію, що вистилає стравохід, еритроцити, особливо численні при аспірації, детрит і, нарешті, при явищах застою - залишки їжі.
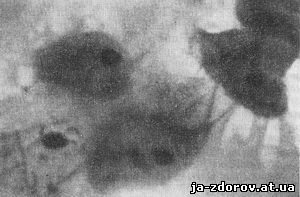
Обривки слизової оболонки стравоходу виглядають у вигляді пластів клітин плоского епітелію з широкою протоплазмою і дрібними круглими ядрами (рис. 41). Іноді в цих пластах зустрічаються шаруваті округлі скупчення епітеліальних клітин, так звані цибулини (рис.42); вони складаються з нормальних клітин і цим відрізняються від таких же утворень, що зустрічаються при плоскоклітинному раку, але складаються з атипових клітин. | |
| Переглядів: 747 | |